Autor:
Judy Howell
Data Creației:
2 Iulie 2021
Data Actualizării:
21 Iunie 2024

Conţinut
- A calca
- Partea 1 din 2: Găsirea numărului atomic
- Partea 2 din 2: Găsirea informațiilor conexe
- sfaturi
Numărul atomic al unui element este numărul de protoni din nucleul unui singur atom al acelui element. Numărul atomic al unui element sau izotop nu se modifică, deci puteți utiliza numărul atomic pentru a calcula alte caracteristici ale unui element sau izotop, cum ar fi numărul de neutroni.
A calca
Partea 1 din 2: Găsirea numărului atomic
 Găsiți o copie a tabelului periodic. Puteți găsi unul aici dacă nu aveți unul la îndemână. Fiecare element are un număr atomic diferit, deci nu există metode rapide și ușoare disponibile. Va trebui fie să găsiți o copie a tabelului periodic, fie să memorați unul.
Găsiți o copie a tabelului periodic. Puteți găsi unul aici dacă nu aveți unul la îndemână. Fiecare element are un număr atomic diferit, deci nu există metode rapide și ușoare disponibile. Va trebui fie să găsiți o copie a tabelului periodic, fie să memorați unul. - Majoritatea manualelor de chimie au un tabel periodic tipărit pe interiorul copertei.
 Găsiți elementul pe care îl studiați. Majoritatea tabelelor periodice conțin numele complete ale diferitelor elemente, precum și simbolurile lor chimice (cum ar fi Hg pentru mercur). Dacă aveți probleme la găsirea elementului, căutați online „simbol chimic” urmat de numele elementului.
Găsiți elementul pe care îl studiați. Majoritatea tabelelor periodice conțin numele complete ale diferitelor elemente, precum și simbolurile lor chimice (cum ar fi Hg pentru mercur). Dacă aveți probleme la găsirea elementului, căutați online „simbol chimic” urmat de numele elementului.  Găsiți numărul atomic. Numărul atomic este de obicei în colțul din stânga sus sau din dreapta al casetei care conține elementul, dar poate fi, de asemenea, localizat în altă parte a casetei. Numărul atomic este întotdeauna un număr întreg.
Găsiți numărul atomic. Numărul atomic este de obicei în colțul din stânga sus sau din dreapta al casetei care conține elementul, dar poate fi, de asemenea, localizat în altă parte a casetei. Numărul atomic este întotdeauna un număr întreg. - Dacă este un număr zecimal, probabil că te uiți la masa atomică.
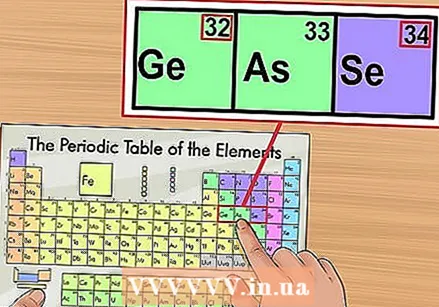 Verificați împotriva elementelor învecinate. Tabelul periodic este ordonat după numărul atomic. Dacă numărul atomic al elementului dvs. este „33”, atunci elementul din stânga ar trebui să fie „32”, iar elementul din dreapta ar trebui să fie „34”. Dacă această ordine este corectă, ați găsit absolut numărul atomic.
Verificați împotriva elementelor învecinate. Tabelul periodic este ordonat după numărul atomic. Dacă numărul atomic al elementului dvs. este „33”, atunci elementul din stânga ar trebui să fie „32”, iar elementul din dreapta ar trebui să fie „34”. Dacă această ordine este corectă, ați găsit absolut numărul atomic. - Poate exista un spațiu gol după elementele 56 (bariu) și 88 (radiu). Nu există de fapt un spațiu; elementele cu numerele atomice care aparțin acolo sunt în două rânduri sub restul sistemului. Singurul motiv pentru care sunt atât de separați este să facă tabelul periodic mai puțin larg.
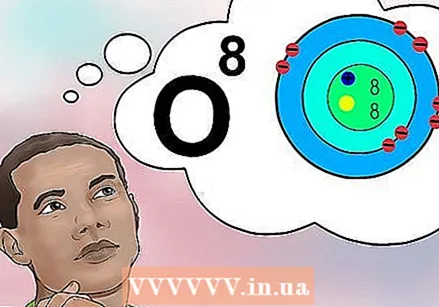 Înțelegeți ce este numărul atomic. Există o definiție simplă pentru numărul atomic al unui element: numărul de protoni dintr-un atom din acel element. Aceasta este definiția de bază a unui element. Numărul de protoni determină sarcina electrică totală a nucleului, care determină câți electroni poate avea un atom. Deoarece electronii sunt responsabili de aproape toate reacțiile chimice, numărul atomic determină indirect aproape toate proprietățile fizice și chimice ale unui element.
Înțelegeți ce este numărul atomic. Există o definiție simplă pentru numărul atomic al unui element: numărul de protoni dintr-un atom din acel element. Aceasta este definiția de bază a unui element. Numărul de protoni determină sarcina electrică totală a nucleului, care determină câți electroni poate avea un atom. Deoarece electronii sunt responsabili de aproape toate reacțiile chimice, numărul atomic determină indirect aproape toate proprietățile fizice și chimice ale unui element. - Cu alte cuvinte, fiecare atom cu opt protoni este un atom de oxigen. Doi atomi de oxigen pot avea un număr diferit de neutroni sau (dacă unul este un ion) un număr diferit de electroni, dar ambii vor avea întotdeauna opt protoni.
Partea 2 din 2: Găsirea informațiilor conexe
 Găsirea greutății atomice. Greutatea atomică este tipărită de obicei sub numele elementului în cauză pe tabelul periodic și este de obicei calculată cu precizie la două sau trei zecimale. Aceasta este masa medie a unui singur atom al elementului, ajustată pentru a se potrivi cu ceea ce este posibil să găsiți în natură. Acest număr este în „unități de masă atomică” (AMU (din engleză „unitate de masă atomică”)).
Găsirea greutății atomice. Greutatea atomică este tipărită de obicei sub numele elementului în cauză pe tabelul periodic și este de obicei calculată cu precizie la două sau trei zecimale. Aceasta este masa medie a unui singur atom al elementului, ajustată pentru a se potrivi cu ceea ce este posibil să găsiți în natură. Acest număr este în „unități de masă atomică” (AMU (din engleză „unitate de masă atomică”)). - Unii oameni de știință folosesc termenul „masă atomică relativă” în loc de „greutate atomică”.
 Înțelegeți masa atomică. Masa atomică este un concept foarte asemănător cu cel al greutății atomice. Singura diferență este că vorbiți despre un atom specific în loc de media unui eșantion de testare. Un gram de fier conține o mulțime de atomi cu mase care diferă ușor unul de celălalt, așa că căutați „greutatea relativă” pentru a găsi media. Dacă sunteți interesat doar de un anumit atom de fier, nu vă pasă de medie - sunteți interesat doar de masa exactă a acelui atom specific.
Înțelegeți masa atomică. Masa atomică este un concept foarte asemănător cu cel al greutății atomice. Singura diferență este că vorbiți despre un atom specific în loc de media unui eșantion de testare. Un gram de fier conține o mulțime de atomi cu mase care diferă ușor unul de celălalt, așa că căutați „greutatea relativă” pentru a găsi media. Dacă sunteți interesat doar de un anumit atom de fier, nu vă pasă de medie - sunteți interesat doar de masa exactă a acelui atom specific. - În practică, masa atomică este de obicei dată deja pentru problemele chimice care privesc doar un atom. Înțelegeți acest concept astfel încât să nu fiți surprinși dacă diferă de greutatea atomică.
 Rotund la numărul de masă. Numărul de masă este numărul total de protoni plus neutroni dintr-un atom al unui element. Puteți găsi acest număr cu ușurință: luați greutatea atomică dată în tabelul periodic și rotunjiți la cel mai apropiat număr întreg.
Rotund la numărul de masă. Numărul de masă este numărul total de protoni plus neutroni dintr-un atom al unui element. Puteți găsi acest număr cu ușurință: luați greutatea atomică dată în tabelul periodic și rotunjiți la cel mai apropiat număr întreg. - Acest lucru funcționează deoarece neutronii și protonii sunt ambii în jurul valorii de 1 AMU, iar electronii sunt aproape de 0 AMU. Măsurătorile precise sunt folosite pentru greutatea atomică pentru a obține numărul zecimal, dar ne interesează doar numerele întregi care ne indică numărul de protoni și neutroni.
- Amintiți-vă, utilizarea greutății atomice vă va oferi o medie pentru un eșantion tipic. O probă de brom are un număr de masă de aproximativ 80, dar, după cum se poate observa, un singur atom de brom are aproape întotdeauna un număr de masă de 79 sau 81.
 Calculați numărul de neutroni. Acum știți că numărul atomic = numărul de protoni și că numărul de masă = numărul de protoni + numărul de neutroni. Pentru a afla câți neutroni există într-un element, trebuie să scădeți numărul atomic din numărul de masă. Iată câteva exemple:
Calculați numărul de neutroni. Acum știți că numărul atomic = numărul de protoni și că numărul de masă = numărul de protoni + numărul de neutroni. Pentru a afla câți neutroni există într-un element, trebuie să scădeți numărul atomic din numărul de masă. Iată câteva exemple: - Un singur atom de heliu (He) are un număr de masă 4 și un număr atomic de 2. Prin urmare, trebuie să fie 4 - 2 = 2 neutroni a avea.
- Un eșantion de argint (Ag) are un număr de masă de aproximativ 108 (conform tabelului periodic) și un număr atomic de 47. În medie, fiecare atom de argint din eșantion are 108 - 47 = 61 neutroni.
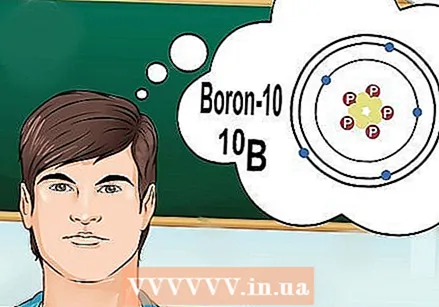 Înțelegeți ce sunt izotopii. Un izotop este o formă specifică a unui element cu un anumit număr de neutroni. Când o întrebare de chimie se referă la „bor-10” sau „B”, se referă la elementul de bor cu un număr de masă 10. Folosiți acest număr de masă în loc de valoarea „tipică” a borului.
Înțelegeți ce sunt izotopii. Un izotop este o formă specifică a unui element cu un anumit număr de neutroni. Când o întrebare de chimie se referă la „bor-10” sau „B”, se referă la elementul de bor cu un număr de masă 10. Folosiți acest număr de masă în loc de valoarea „tipică” a borului. - Izotopii nu au un număr atomic diferit. Fiecare izotop al unui element are același număr de protoni.
sfaturi
- Unele elemente mai grele au o greutate atomică care este închisă între paranteze sau paranteze. Aceasta înseamnă că greutatea atomică este masa exactă a izotopului cel mai stabil, mai degrabă decât media mai multor izotopi. (Acest lucru nu are niciun efect asupra numărului atomic al elementului.)