Autor:
Lewis Jackson
Data Creației:
12 Mai 2021
Data Actualizării:
1 Iulie 2024
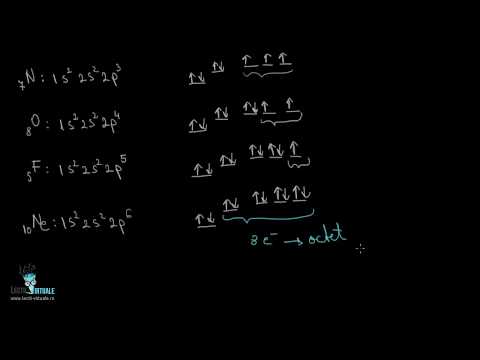
Conţinut
Configuratie electronica a unui atom este o serie de numere reprezentând orbitalii electronilor. Obitanii electronici sunt regiunile spațiale de diferite forme care înconjoară nucleul unui atom, în care electronii sunt dispuși în mod ordonat. Prin configurația electronică puteți determina rapid câți orbitali de electroni sunt în atom și numărul de electroni din fiecare orbital. Odată ce ați înțeles principiile de bază ale configurației electronice, veți putea scrie propria configurație electronică și veți putea face teste chimice cu încredere.
Pași
Metoda 1 din 2: Determinați numărul de electroni folosind un tabel periodic chimic
Găsiți numărul atomic al atomului. Fiecare atom are un număr specific de electroni asociați. Localizați elementul pe tabelul periodic. Numărul atomic este un număr întreg pozitiv începând de la 1 (pentru hidrogen) și crescând cu 1 pentru fiecare atom ulterior. Numărul atomic este numărul de protoni ai atomului - deci este și numărul de electroni ai atomului în starea fundamentală.
- Determinați sarcina atomului. Un atom neutru din punct de vedere electric are numărul corect de electroni, așa cum se arată pe tabelul periodic. Cu toate acestea, un atom cu sarcină va avea mai mulți sau mai puțini electroni pe baza magnitudinii sarcinii sale. Dacă lucrați cu atomi cu sarcină, adăugați sau scădeți numărul corespunzător de electroni: adăugați un electron pentru fiecare sarcină negativă și scădeți un electron pentru fiecare sarcină pozitivă.
- De exemplu, un atom de sodiu cu o sarcină de +1 va avea un electron eliminat din numărul atomic de bază 11. Prin urmare, atomul de sodiu va avea un total de 10 electroni.
- Memorează lista orbitală de bază. Când un atom primește electroni, acești electroni vor fi aranjați pe orbitați într-o ordine specifică. Când electronii umple orbitali, numărul de electroni din fiecare orbital este egal. Avem următorii orbitali:
- Obitan s (orice număr cu un „s” în spatele configurației electronice) are un singur orbital și urmează Principiul cu excepția lui PauliFiecare orbital conține maximum 2 electroni, deci fiecare orbital conține doar 2 electroni.
- Obitan p are 3 orbitali, deci poate conține până la 6 electroni.
- Obitan d are 5 orbitali, deci poate conține până la 10 electroni.
- Obitan f are 7 orbitali, deci poate conține până la 14 electroni. Memorați ordinea orbitalilor conform următoarei propoziții atrăgătoare:
Spe Pagresiv Duh Fbine Gamorțit HHopa ÍKEu vin.
Pentru atomii cu mai mulți electroni, orbitalele continuă să fie scrise alfabetic după litera k, lăsând în afara caracterele care au fost folosite.
- Înțelegeți configurația electronică. Configurațiile electronice sunt scrise pentru a arăta în mod clar numărul de electroni din atom, precum și numărul de electroni din fiecare orbital. Fiecare orbital este scris într-o anumită ordine, cu numărul de electroni din fiecare orbital scris deasupra dreptului numelui orbital. În cele din urmă configurația electronică este o secvență constând din numele orbitalilor și numărul de electroni scrise mai sus în dreapta acestora.
- Următorul exemplu este o configurație simplă de electroni: 1s 2s 2p. Această configurație arată că există doi electroni în orbitalul 1s, doi electroni în orbitalul 2s și șase electroni în orbitalul 2p. 2 + 2 + 6 = 10 electroni (total). Această configurație electronică este pentru un atom de neon neutru din punct de vedere electric (numărul atomic al neonului este 10).
- Memorează ordinea orbitalilor. Rețineți că orbitalele sunt numerotate în funcție de clasa electronilor, dar sunt ordonate energetic. De exemplu, orbitalul 4s este saturat cu o energie mai mică (sau mai durabilă) decât orbitalul 3d saturat sau nesaturat, astfel încât subclasa 4s este scrisă mai întâi. Odată ce cunoașteți ordinea orbitalilor, puteți organiza electronii în ele în funcție de numărul de electroni din atom. Ordinea pentru plasarea electronilor în orbitali este următoarea: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- Configurația electronică a unui atom cu fiecare orbital plin de electroni este scrisă astfel: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Rețineți că, dacă toate straturile sunt umplute, configurația electronică de mai sus este cea a lui Og (Oganesson), 118, care este cel mai mare atom numerotat de pe tabelul periodic - conținând toate straturile electronice cunoscute în prezent pentru cu un atom neutru electric.
- Sortați electronii în orbitali în funcție de numărul de electroni din atom. De exemplu, dacă doriți să scrieți configurația electronică a atomului de calciu neutru din punct de vedere electric, primul lucru de făcut este să găsiți numărul său atomic pe tabelul periodic. Numărul atomic de calciu este 20, deci vom scrie configurația unui atom cu 20 de electroni în ordinea de mai sus.
- Puneți-vă electronii în orbitali în ordinea de mai sus până când ajungeți la 20 de electroni. Obitan 1s primește doi electroni, 2s primește doi, 2p primește șase, 3s primește doi, 3p primește șase și 4s primește doi electroni (2 + 2 + 6 +2 +6 + 2 = 20). Prin urmare, configurația electronică a calciului este: 1s 2s 2p 3s 3p 4s.
- Notă: Nivelul de energie se schimbă pe măsură ce stratul de electroni crește. De exemplu, atunci când scrieți la cel de-al 4-lea nivel de energie, subclasa 4s este scrisă mai întâi, mai tarziu la 3d. După ce scrieți al patrulea nivel de energie, veți trece la al cincilea nivel și veți relua ordinea de stratificare. Acest lucru se întâmplă numai după al treilea nivel de energie.
- Utilizați tabelul periodic ca o comandă rapidă vizuală. Este posibil să fi observat că forma tabelului periodic corespunde ordinii orbitalilor din configurația electronică. De exemplu, atomii din a doua coloană de la stânga la dreapta se termină întotdeauna la „s”, atomii din partea extremă dreaptă a secțiunii din mijloc se termină întotdeauna la „d” etc. Folosiți tabelul periodic pentru a scrie structuri. figura - ordinea în care electronii sunt așezați pe orbitali va corespunde pozițiilor afișate pe tabelul periodic. Vezi mai jos:
- Cele două coloane din stânga sunt atomi a căror configurație electronică se termină în orbitalul s, partea dreaptă a tabelului periodic sunt atomi cu o configurație electronică care se termină în orbitalul p, partea din mijloc este atomi care se termină în orbitalul s. d, iar dedesubt sunt atomii care se termină în orbitalul f.
- De exemplu, atunci când scrieți o configurație electronică a elementului clor, formulați următorul argument: Acest atom se află în al treilea rând (sau „perioadă”) din tabelul periodic. Se află și în a cincea coloană a blocului orbital p pe tabelul periodic. Deci configurația electronică va sfârși ... 3p.
- Atent! Clasele orbitale d și f de pe tabelul periodic corespund unor niveluri de energie diferite de perioada lor. De exemplu, primul rând al blocului orbital d corespunde orbitalului 3d chiar dacă este în perioada 4, în timp ce primul rând al orbitei f corespunde orbitei 4f chiar dacă este în perioada 6.
- Aflați cum să scrieți configurații pliabile de electroni. Se numesc atomii de-a lungul marginii drepte a tabelului periodic gaz rar. Aceste elemente sunt foarte inerte din punct de vedere chimic. Pentru a scurta modul de scriere a configurațiilor electronice lungi, scrieți între paranteze pătrate simbolul chimic pentru cel mai apropiat gaz rar care are mai puțini electroni decât cel al atomului și apoi continuați să scrieți configurațiile electronice ale următorilor orbitali. . Vezi mai jos:
- Pentru a înțelege acest concept, scrieți un exemplu de configurație electronică prăbușită. Să presupunem că trebuie să scriem configurația electronică pentru reducerea zincului (numărul atomic 30) printr-o configurație de gaz rară. Configurația completă de electroni a zincului este: 1s 2s 2p 3s 3p 4s 3d. Rețineți, totuși, că 1s 2s 2p 3s 3p este configurația pentru gazul agonic rar. Doar înlocuiți această parte a notației electronice a zincului cu simbolul chimic agonic între paranteze pătrate ().
- Prin urmare, configurația electronică a zincului este compactă 4s 3d.
Metoda 2 din 2: Utilizarea tabelului periodic ADOMAH

Explorează tabelul periodic ADOMAH. Această metodă de scriere a configurației electronice nu necesită memorare. Cu toate acestea, această metodă necesită un tabel periodic rearanjat, deoarece într-un tabel periodic obișnuit, de la al patrulea rând, numărul de cicluri nu corespunde stratului de electroni. Găsiți un tabel periodic ADOMAH, un tabel periodic chimic special conceput de omul de știință Valery Tsimmerman. Puteți găsi acest tabel periodic pe internet.- În tabelul periodic ADOMAH, rândurile orizontale sunt grupuri de elemente precum halogeni, gaze inerte, metale alcaline, metale alcalino-pământoase etc. Coloanele verticale corespund stratului de electroni și sunt numite „trepte” (joncțiuni diagonale). blocurile s, p, d și f) corespund perioadei.
- Heliul este aranjat lângă hidrogen, deoarece ambele au un orbital unic 1s. Blocurile periodice (s, p, d și f) sunt prezentate în partea dreaptă și numărul straturilor de electroni este afișat la bază. Numele elementelor sunt scrise într-un dreptunghi numerotat de la 1 la 120. Aceste numere sunt numerele atomice obișnuite, reprezentând numărul total de electroni dintr-un atom neutru din punct de vedere electric.
- Găsiți elementul din tabelul periodic ADOMAH. Pentru a scrie o configurație electronică pentru un element, localizați simbolul acestuia pe Tabelul periodic ADOMAH și tăiați toate elementele cu numere atomice mai mari. De exemplu, dacă doriți să scrieți configurația electronică a eribi (68), tăiați elementele de la 69 la 120.
- Observați numerele de la 1 la 8 la baza tabelului periodic. Acesta este numărul de straturi sau coloane de electroni. Nu acordați atenție coloanelor care au doar elemente tăiate.Pentru eribi, coloanele rămase sunt 1, 2, 3, 4, 5 și 6.
- Numărați numărul de orbitali până la poziția atomului pentru a scrie configurația. Uită-te la simbolul blocului afișat în dreapta tabelului periodic (s, p, d și f) și uită-te la numărul de coloane afișat la baza tabelului, indiferent de liniile diagonale dintre blocuri, împarte coloanele în blocuri de coloane și scrie sunt în ordine de jos în sus. Ignorați blocurile de coloane care conțin doar elemente tăiate. Notați blocurile de coloane începând cu numărul coloanei și apoi simbolul blocului, astfel: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (în cazul eribi).
- Notă: Configurația electronică de mai sus pentru Er este scrisă în ordine crescătoare a numărului de straturi de electroni. Această configurație poate fi scrisă și în ordinea plasării electronilor în orbitali. Urmați pașii de sus în jos în loc de coloane când scrieți blocuri de coloane: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Numărați numărul de electroni pe orbital. Numărați numărul de electroni care nu sunt tăiați în fiecare bloc coloană, atribuiți un electron pe element și scrieți numărul de electroni lângă simbolul blocului pentru fiecare coloană bloc, astfel: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. În acest exemplu, aceasta este configurația electronică a eribi.
- Recunoașteți configurațiile anormale ale electronilor. Există optsprezece excepții comune la configurația electronică a atomilor în starea de energie cea mai scăzută, cunoscută și sub numele de starea de bază. În comparație cu regula generală, ele deviază doar de la ultimele două până la trei poziții ale electronilor. În acest caz, configurația electronică efectivă determină electronii să aibă o stare de energie mai mică decât configurația standard a atomului. Atomii neobișnuiți sunt:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Doamne (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) și Cm (..., 5f7, 6d1, 7s2).
Sfat
- Când atomul este un ion, înseamnă că numărul de protoni nu este egal cu numărul de electroni. Încărcarea atomului este apoi afișată în colțul din dreapta sus (de obicei) al simbolului elementului. Prin urmare, un atom de antimoniu cu încărcare +2 va avea o configurație electronică de 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Rețineți că 5p este schimbat în 5p. Aveți grijă când configurația unui atom neutru din punct de vedere electric se termină în orbitali diferiți de s și p. Cu electronii eliminați, puteți lua electroni doar de pe orbitalele de valență (orbitalele s și p). Deci, dacă o configurație se termină la 4s 3d, iar atomul are o încărcare de +2, configurația se schimbă la 4s 3d. Vedem 3dconstant, dar numai electronii din orbitalul sunt îndepărtați.
- Toți atomii tind să revină la o stare stabilă, iar cea mai stabilă configurație de electroni va avea suficient orbital s și p (s2 și p6). Aceste gaze rare au această configurație electronică, motiv pentru care rareori participă la reacții și se află pe partea dreaptă a tabelului periodic. Deci, dacă o configurație se termină la 3p, are nevoie doar de încă doi electroni pentru a deveni stabilă (oferirea a șase electroni, inclusiv cei ai orbitei s, va necesita mai multă energie, deci oferirea a patru electroni ar fi ușoară Mai ușor). Dacă o configurație se termină la 4d, trebuie doar să dea trei electroni pentru a ajunge la o stare stabilă. La fel, noile subclase care primesc jumătate din electroni (s1, p3, d5 ..) sunt mai stabile, de exemplu p4 sau p2, dar s2 și p6 vor fi și mai stabile.
- De asemenea, puteți utiliza configurația electronică de valență pentru a scrie configurația electronică a unui element, care este ultimul orbital s și p. Prin urmare, configurația de valență a unui atom de antimoniu pentru un antimoniu este 5s 5p.
- Ionilor nu le place asta pentru că sunt mult mai durabili. Treceți peste cei doi pași de mai sus ai acestui articol și lucrați la fel, în funcție de unde începeți și de câți sau mai puțini electroni aveți.
- Pentru a găsi numărul atomic din configurația sa electronică, adăugați toate numerele care urmează literele (s, p, d și f). Acest lucru este corect numai dacă este un atom neutru, dacă este un ion, atunci nu puteți utiliza această metodă. În schimb, trebuie să adăugați sau să scădeți numărul de electroni pe care îi luați sau îi dați.
- Numărul care urmează literei trebuie scris în colțul din dreapta sus, nu trebuie să scrieți greșit atunci când susțineți testul.
- Există două moduri diferite de a scrie configurații de electroni. Puteți scrie în ordinea crescătoare a stratului de electroni sau în ordinea în care electronii sunt așezați în orbitali, așa cum se arată pentru atomul eribi.
- Există cazuri în care un electron trebuie „împins în sus”. Atunci când un orbital lipsește doar un electron pentru a avea jumătate sau toți electronii, atunci trebuie să luați un electron din cel mai apropiat orbital s sau p pentru a-l transfera în orbitalul care are nevoie de acel electron.
- Nu putem spune că „stabilitatea fracției energetice” a subclasei primește jumătate din electroni. Aceasta este o simplificare excesivă. Motivul pentru nivelul de energie stabil al noii subclase care primește „jumătate din numărul de electroni” este acela că fiecare orbital are un singur electron, deci repulsia electron-electron este minimizată.