Autor:
Florence Bailey
Data Creației:
21 Martie 2021
Data Actualizării:
1 Iulie 2024
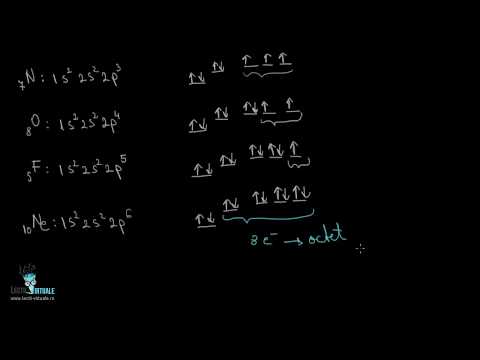
Conţinut
- Pași
- Metoda 1 din 2: Distribuția electronilor utilizând sistemul periodic al lui I. I. Mendeleev
- Metoda 2 din 2: Utilizarea Tabelului periodic ADOMAH
- sfaturi
Configurare electronică un atom este o reprezentare numerică a orbitalilor săi de electroni. Orbitalii electronici sunt regiuni de diferite forme situate în jurul unui nucleu atomic în care un electron este probabil din punct de vedere matematic. Configurația electronică ajută la indicarea rapidă și ușoară a cititorului a orbitalilor de electroni pe care îi are un atom, precum și la determinarea numărului de electroni din fiecare orbital. După ce ați citit acest articol, veți fi stăpânit metoda de generare a configurațiilor electronice.
Pași
Metoda 1 din 2: Distribuția electronilor utilizând sistemul periodic al lui I. I. Mendeleev
 1 Găsiți numărul atomic al atomului dvs. Fiecare atom are un număr specific de electroni asociați. Găsiți simbolul atomului dvs. în tabelul periodic. Un număr atomic este un număr întreg pozitiv începând de la 1 (pentru hidrogen) și crescând cu unul pentru fiecare atom ulterior. Un număr atomic este numărul de protoni dintr-un atom și, prin urmare, este și numărul de electroni dintr-un atom cu sarcină zero.
1 Găsiți numărul atomic al atomului dvs. Fiecare atom are un număr specific de electroni asociați. Găsiți simbolul atomului dvs. în tabelul periodic. Un număr atomic este un număr întreg pozitiv începând de la 1 (pentru hidrogen) și crescând cu unul pentru fiecare atom ulterior. Un număr atomic este numărul de protoni dintr-un atom și, prin urmare, este și numărul de electroni dintr-un atom cu sarcină zero. - 2 Determinați sarcina unui atom. Atomii neutri vor avea același număr de electroni ca în tabelul periodic. Cu toate acestea, atomii încărcați vor avea mai mulți sau mai puțini electroni, în funcție de cantitatea de încărcare a acestora. Dacă lucrați cu un atom încărcat, adăugați sau scădeți electroni după cum urmează: adăugați un electron pentru fiecare sarcină negativă și scădeți unul pentru fiecare pozitiv.
- De exemplu, un atom de sodiu cu o încărcare de -1 va avea un electron suplimentar în plus la numărul său atomic de bază 11. Cu alte cuvinte, atomul total va avea 12 electroni.
- Dacă vorbim despre un atom de sodiu cu o sarcină de +1, un electron trebuie scăzut din numărul atomic de bază 11. Astfel, atomul va avea 10 electroni.
- 3 Amintiți-vă lista de bază a orbitalilor. Pe măsură ce numărul de electroni crește, aceștia umple diferitele subnivele ale învelișului de electroni al atomului conform unei anumite secvențe. Fiecare subnivel al învelișului de electroni, atunci când este umplut, conține un număr par de electroni. Sunt disponibile următoarele niveluri secundare:
- s-subnivel (orice număr din configurația electronică care vine înainte de litera „s”) conține un singur orbital și, conform Principiul lui Pauli, un orbital poate conține maximum 2 electroni, prin urmare, pot exista 2 electroni pe fiecare subnivel al învelișului de electroni.
- p-subnivel conține 3 orbitali și, prin urmare, poate conține maximum 6 electroni.
- d-subnivel conține 5 orbitali, deci poate avea până la 10 electroni.
- f-subnivel conține 7 orbitali, deci poate avea până la 14 electroni.
- subnivele g-, h-, i- și k sunt teoretice. Atomii care conțin electroni în acești orbitali sunt necunoscuți. Subnivelul g conține 9 orbitali, deci teoretic ar putea avea 18 electroni. Subnivelul h poate avea 11 orbitali și maximum 22 de electroni; în i-subnivelul -13 orbitali și maximum 26 de electroni; în subnivelul k - 15 orbitali și maximum 30 de electroni.
- Memorează ordinea orbitalilor folosind trucul mnemonic:
Sober Pfizicieni Dpe t Find Giraffes Hiding Eun Kmâncărimi (fizicienii sobri nu găsesc girafe ascunse în bucătării).
- 4 Înțelegeți înregistrarea de configurare electronică. Configurațiile electronice sunt înregistrate pentru a reflecta în mod clar numărul de electroni din fiecare orbital. Orbitalele sunt scrise secvențial, numărul de atomi din fiecare orbital fiind superscript în dreapta numelui orbital. Configurația electronică finalizată ia forma unei secvențe de desemnări de subnivel și supercripturi.
- De exemplu, cea mai simplă configurație electronică: 1s 2s 2p. Această configurație arată că există doi electroni la subnivelul 1s, doi electroni la subnivelul 2s și șase electroni la subnivelul 2p. 2 + 2 + 6 = 10 electroni în total. Aceasta este configurația electronică a unui atom de neon neutru (numărul atomului de neon este 10).
- 5 Amintiți-vă ordinea orbitalilor. Rețineți că orbitalele electronilor sunt numerotate în ordine crescătoare a numărului de coajă de electroni, dar în ordine crescătoare de energie. De exemplu, un orbital 4s umplut este mai puțin energic (sau mai puțin mobil) decât un 3d parțial umplut sau umplut, astfel încât orbitalul 4s este înregistrat mai întâi. Odată ce cunoașteți ordinea orbitalilor, le puteți completa cu ușurință în funcție de numărul de electroni din atom. Ordinea de umplere a orbitalilor este următoarea: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Configurația electronică a unui atom în care sunt umplute toate orbitalele va avea următoarea formă: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Rețineți că intrarea de mai sus, atunci când toate orbitalele sunt umplute, este configurația electronică a elementului Uuo (ununoctium) 118, cel mai numeros atom din tabelul periodic. Prin urmare, această configurație electronică conține toate nivelurile electronice cunoscute în prezent ale unui atom încărcat neutru.
- 6 Completați orbitalele în funcție de numărul de electroni din atomul dvs. De exemplu, dacă dorim să notăm configurația electronică a unui atom de calciu neutru, trebuie să începem prin a căuta numărul său atomic în tabelul periodic. Numărul său atomic este 20, deci vom scrie configurația unui atom cu 20 de electroni conform ordinii de mai sus.
- Completați orbitalele în ordinea de mai sus până ajungeți la al douăzecilea electron. Primul orbital 1s va conține doi electroni, orbitalii 2s vor avea și doi, 2p - șase, 3s - doi, 3p - 6 și 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20.) În cu alte cuvinte, configurația electronică a calciului este: 1s 2s 2p 3s 3p 4s.
- Rețineți că orbitalii sunt în ordine crescătoare de energie. De exemplu, atunci când sunteți gata să vă deplasați la cel de-al 4-lea nivel de energie, atunci scrieți mai întâi orbitalul 4s și apoi 3d. După al patrulea nivel de energie, mergi la al cincilea, unde se repetă aceeași ordine. Acest lucru se întâmplă numai după al treilea nivel de energie.
- 7 Utilizați tabelul periodic ca un indiciu vizual. Probabil că ați observat deja că forma tabelului periodic corespunde ordinii subnivelelor electronice din configurațiile electronice. De exemplu, atomii din a doua coloană din stânga se termină întotdeauna cu „s”, în timp ce atomii de pe marginea dreaptă a secțiunii medii subțiri se termină întotdeauna cu „d” și așa mai departe. Utilizați tabelul periodic ca ghid vizual pentru configurațiile de scriere - deoarece ordinea în care adăugați orbitalelor corespunde poziției dvs. în tabel. Vezi mai jos:
- În special, cele două coloane din stânga conțin atomi ale căror configurații electronice se termină în orbitale s, blocul din dreapta al tabelului conține atomi ale căror configurații se termină în orbitali p, iar în partea inferioară, atomii se termină în orbitali f.
- De exemplu, atunci când notați configurația electronică a clorului, gândiți-vă astfel: „Acest atom este situat în al treilea rând (sau„ punct ”) al tabelului periodic. De asemenea, este situat în grupul al cincilea al blocului orbital p a sistemului periodic. Prin urmare, configurația sa electronică se va termina în .3p
- Vă rugăm să rețineți: elementele din regiunea orbitalelor d și f ale tabelului sunt caracterizate de niveluri de energie care nu corespund perioadei în care sunt situate. De exemplu, primul rând al blocului de elemente cu orbitale d corespunde orbitalelor 3d, deși este situat în a 4-a perioadă, iar primul rând de elemente cu orbitale f corespunde orbitalului 4f, în ciuda faptului că este în perioada a 6-a.
- 8 Aflați stenograma pentru scrierea configurațiilor electronice lungi. Se numesc atomii de pe marginea dreaptă a tabelului periodic gaze nobile. Aceste elemente sunt foarte stabile din punct de vedere chimic. Pentru a scurta procesul de scriere a configurațiilor electronice lungi, pur și simplu scrieți între paranteze pătrate simbolul chimic al celui mai apropiat gaz nobil cu mai puțini electroni decât atomul dvs. și apoi continuați să scrieți configurația electronică a nivelurilor orbitale ulterioare. Vezi mai jos:
- Pentru a înțelege acest concept, este util să scrieți un exemplu de configurație. Să scriem configurația pentru zinc (numărul atomic 30) folosind abrevierea de gaz nobil. Configurația completă de zinc arată astfel: 1s 2s 2p 3s 3p 4s 3d. Cu toate acestea, vedem că 1s 2s 2p 3s 3p este configurația electronică a argonului, un gaz nobil. Pur și simplu înlocuiți porțiunea de configurare electronică a zincului cu simbolul chimic argon între paranteze pătrate ([Ar].)
- Deci, configurația electronică a zincului, scrisă într-o formă prescurtată, este: [Ar] 4s 3d.
- Rețineți că, dacă scrieți configurația electronică a unui gaz nobil, să spunem argon, nu puteți scrie [Ar]! Trebuie să folosiți reducerea gazului nobil cu care se confruntă acest element; pentru argon va fi neon ([Ne]).
Metoda 2 din 2: Utilizarea Tabelului periodic ADOMAH
 1 Aflați tabelul periodic ADOMAH. Această metodă de înregistrare a configurației electronice nu necesită memorare, însă necesită un tabel periodic revizuit, întrucât în tabelul periodic tradițional, începând cu a patra perioadă, numărul perioadei nu corespunde coajei electronilor. Găsiți Tabelul periodic ADOMAH - un tip special de tabel periodic dezvoltat de omul de știință Valery Zimmerman. Este ușor de găsit cu o scurtă căutare pe Internet.
1 Aflați tabelul periodic ADOMAH. Această metodă de înregistrare a configurației electronice nu necesită memorare, însă necesită un tabel periodic revizuit, întrucât în tabelul periodic tradițional, începând cu a patra perioadă, numărul perioadei nu corespunde coajei electronilor. Găsiți Tabelul periodic ADOMAH - un tip special de tabel periodic dezvoltat de omul de știință Valery Zimmerman. Este ușor de găsit cu o scurtă căutare pe Internet. - În tabelul periodic al ADOMAH, rândurile orizontale reprezintă grupuri de elemente precum halogeni, gaze nobile, metale alcaline, metale alcalino-pământoase etc. Coloanele verticale corespund nivelurilor electronice și așa-numitele „cascade” (linii diagonale care leagă blocurile s, p, d și f) corespund perioadelor.
- Heliul este mutat în hidrogen, deoarece ambele elemente au un orbital 1s. Blocurile de perioadă (s, p, d și f) sunt afișate în partea dreaptă, iar numerele de nivel sunt afișate în partea de jos. Elementele sunt prezentate în casetele numerotate de la 1 la 120. Aceste numere sunt numere atomice comune care reprezintă numărul total de electroni dintr-un atom neutru.
- 2 Găsiți-vă atomul în tabelul ADOMAH. Pentru a înregistra configurația electronică a unui element, găsiți simbolul acestuia în tabelul periodic ADOMAH și tăiați toate elementele cu un număr atomic mai mare. De exemplu, dacă trebuie să notați configurația electronică a erbiului (68), tăiați toate elementele de la 69 la 120.
- Rețineți numerele de la 1 la 8 în partea de jos a tabelului. Acestea sunt numere de nivel electronic sau numere de coloană. Ignorați coloanele care conțin numai elemente tăiate.Pentru erbiu, coloanele numerotate 1, 2, 3, 4, 5 și 6 rămân.
- 3 Numărați subnivelele orbitale la elementul dvs. Privind simbolurile de blocuri afișate în dreapta tabelului (s, p, d și f) și numerele de coloane afișate în partea de jos, ignorați liniile diagonale dintre blocuri și rupeți coloanele în blocuri de coloane în ordine de jos sus. Din nou, ignorați casetele cu toate elementele tăiate. Notați blocurile de coloane, începând cu numărul coloanei urmat de simbolul blocului, astfel: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (pentru erbiu).
- Notă: Configurația electronică de mai sus Er este scrisă în ordine crescătoare a numărului de subnivel electronic. Poate fi scris și în ordinea umplerii orbitalilor. Pentru a face acest lucru, urmați cascadele de jos în sus, nu coloanele atunci când scrieți blocurile de coloane: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Numărați electronii pentru fiecare subnivel electronic. Numărați elementele din fiecare coloană bloc care nu au fost tăiate, atașând un electron din fiecare element și scrieți numărul lor lângă simbolul blocului pentru fiecare coloană bloc astfel: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s ... În exemplul nostru, aceasta este configurația electronică a erbiului.
- 5 Luați în considerare configurațiile electronice incorecte. Există optsprezece excepții tipice legate de configurațiile electronice ale atomilor în starea cu cea mai mică energie, numită și starea energiei solului. Ei nu respectă regula generală doar în ultimele două sau trei poziții ocupate de electroni. În acest caz, configurația electronică reală presupune că electronii se află într-o stare cu o energie mai mică în comparație cu configurația standard a atomului. Atomii de excepție includ:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Doamne (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) și Cm (..., 5f7, 6d1, 7s2).
sfaturi
- Pentru a găsi numărul atomic al unui atom atunci când este scris în configurație electronică, pur și simplu adăugați toate numerele care urmează literele (s, p, d și f). Acest lucru funcționează numai pentru atomii neutri, dacă aveți de-a face cu un ion, atunci nimic nu va funcționa - trebuie să adăugați sau să scădeți numărul de electroni în plus sau pierduți.
- Numărul care urmează literei este un indicativ, nu faceți o greșeală în cec.
- Nu există o „stabilitate a unui subnivel„ pe jumătate umplut ”. Aceasta este o simplificare. Orice stabilitate legată de subnivelele „pe jumătate umplute” se datorează faptului că fiecare orbital este ocupat de un electron, deci repulsia dintre electroni este minimizată.
- Fiecare atom tinde spre o stare stabilă, iar configurațiile cele mai stabile au umplut subnivelele s și p (s2 și p6). Gazele nobile au o astfel de configurație, prin urmare rareori intră în reacții și sunt situate în dreapta în tabelul periodic. Prin urmare, dacă configurația se termină la 3p, atunci are nevoie de doi electroni pentru a ajunge la o stare stabilă (pentru a pierde șase, inclusiv electroni ai subnivelului, este necesară mai multă energie, deci este mai ușor să pierzi patru). Și dacă configurația se termină în 4d, atunci trebuie să piardă trei electroni pentru a ajunge la o stare stabilă. În plus, subnivelele pe jumătate umplute (s1, p3, d5 ..) sunt mai stabile decât, de exemplu, p4 sau p2; cu toate acestea, s2 și p6 vor fi și mai robuste.
- Când aveți de-a face cu un ion, aceasta înseamnă că numărul de protoni nu este egal cu numărul de electroni. În acest caz, sarcina unui atom va fi afișată în partea dreaptă sus (de regulă) a simbolului chimic. Prin urmare, un atom de antimoniu cu o sarcină de +2 are configurația electronică 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Rețineți că 5p s-a schimbat în 5p. Aveți grijă când configurația unui atom neutru ajunge la subnivele, altele decât s și p. Când ridicați electroni, îi puteți ridica doar de pe orbitalele de valență (orbitalele s și p).Prin urmare, dacă configurația se termină la 4s 3d și atomul câștigă o încărcare +2, atunci configurația se va termina la 4s 3d. Vă rugăm să rețineți că 3d nu se schimbă, în loc să piardă electroni s-orbitali.
- Există condiții în care electronul este forțat să „meargă la un nivel mai ridicat de energie”. Când unui subnivel îi lipsește un electron până la jumătate sau umplere completă, luați un electron din cel mai apropiat s sau subnivel p și mutați-l în subnivelul care are nevoie de un electron.
- Există două opțiuni pentru înregistrarea unei configurații electronice. Ele pot fi scrise în ordine crescătoare a numerelor de nivel de energie sau în ordinea umplerii orbitalilor de electroni, așa cum s-a arătat mai sus pentru erbiu.
- De asemenea, puteți nota configurația electronică a unui element notând doar configurația de valență, care este ultimul subnivel s și p. Astfel, configurația de valență a antimoniului va avea forma 5s 5p.
- Iona nu este același lucru. Este mult mai dificil cu ei. Treceți peste două niveluri și urmați același tipar în funcție de unde ați început și cât de mare este numărul de electroni.